Da das diffus großzellige B-Zell-Lymphom ein aggressives und rasch wachsendes Lymphom ist, sollte mit der Therapie begonnen werden, sobald die Ergebnisse der Staging-Untersuchungen vorliegen und man auf deren Basis die Therapiestrategie festlegen kann. Ein Hinausschieben der Therapie ist nur in besonderen Situationen gerechtfertigt, beispielsweise bei einer schweren bakteriellen Infektion.
Wer ist auf die Behandlung von diffus großzelligen B-Zell-Lymphomen spezialisiert?
Die Behandlung eines diffus großzelligen B-Zell-Lymphoms sollte nur durch erfahrene Fachärztinnen und Fachärzte für Hämatologie und Onkologie erfolgen. Diese sind sowohl in den entsprechenden Fachabteilungen von Krankenhäusern und Kliniken tätig als auch in niedergelassenen Facharztpraxen.
Die Therapie wurde in den vergangenen Jahren vor allem mit Hilfe von klinischen Therapiestudien stetig verbessert, sodass heute bei vielen Patientinnen und Patienten Heilungsraten von 80 Prozent erreicht werden, wenn die effektiven Therapien konsequent, d.h. in der geplanten Dosis und ohne zeitliche Verzögerungen gegeben werden können. Dennoch ist es wichtig, dass sich auch weiterhin möglichst viele an DLBCL Erkrankte im Rahmen von Studien behandeln lassen. Denn nur wenn unterschiedliche Therapieansätze an möglichst vielen Menschen miteinander verglichen und dokumentiert werden, können weitere Verbesserungen der Heilungsraten erreicht oder besser verträgliche Therapien entwickelt werden. Wegen der strengen Qualitätskontrolle im Rahmen von Studien profitieren auch jene Personen von einer Studienteilnahme, die nicht nach dem Zufallsprinzip einem Therapiearm mit einem neuen, vielversprechenden Medikament zugeteilt werden (= Randomisierung), sondern auch Erkrankte, die eine sogenannte Standardtherapie erhalten. Patientinnen und Patienten sollten ihr Behandlungsteam deshalb immer danach fragen, ob die Behandlung im Rahmen einer Studie möglich ist. Auskünfte zu laufenden Therapiestudien beim DLBCL erteilt das Kompetenznetz maligne Lymphome e.V. oder die Deutsche Studiengruppe für Lymphome (GLA, German Lymphoma Alliance).
Wann sollte mit der Behandlung begonnen werden?
Da das diffus großzellige B-Zell-Lymphom ein aggressives und rasch wachsendes Lymphom ist, sollte mit der Therapie begonnen werden, sobald die Ergebnisse der Staging-Untersuchungen vorliegen und man auf deren Basis die Therapiestrategie festlegen kann. Ein Hinausschieben der Therapie ist nur in besonderen Situationen gerechtfertigt, beispielsweise bei einer schweren
bakteriellen Infektion oder zur Kryokonservierung von Keimgewebe (= Aufbewahren von Zellen oder Gewebe durch Einfrieren in flüssigem Stickstoff) zum Erhalt der Fruchtbarkeit (= Fertilität) bei Erkrankten mit Kinderwunsch.
Erstlinientherapie
Die therapeutische Standard-Strategie für das diffus großzellige B-Zell-Lymphom besteht aus einer Immunchemotherapie mit der Bezeichnung R-CHOP. Immunchemotherapien kombinieren im Labor aus einer Zelllinie hergestellte Antikörper (= monoklonale Antikörper) mit einem oder mehreren chemotherapeutischen Medikamenten (= Zytostatika). Bei der R-CHOP Therapie steht das R für die Immuntherapie mit dem anti-CD20 Antikörper Rituximab. Die Chemotherapie wird mit den Buchstaben CHOP abgekürzt, wobei jeder dieser Buchstaben für ein Medikament steht (C = Cyclophosphamid; H = Doxorubicin; O = Vincristin; P = Prednison).
R-CHOP kann im Abstand von zwei (R-CHOP-14) oder drei Wochen (R-CHOP-21) gegeben werden, wobei es keinen Unterschied in der Effektivität zwischen mit R-CHOP-14 oder R-CHOP-21 behandelten Gruppen gibt. Es kommen in der Regel sechs Durchgänge (= Zyklen) von R-CHOP zur Anwendung. Bei Patientinnen und Patienten mit niedrigstem klinischen Risiko (IPI=0, Alter unter 60 Jahren und kein Bulk) kann die Therapie auch auf vier Zyklen CHOP mit sechs Gaben Rituximab reduziert werden. Dies ist ein Beispiel für eine jüngst beendete Therapieoptimierungsstudie, durch die Patientinnen und Patienten heute von einer Toxizitätsreduktion bei gleicher Effektivität profitieren.
Standard für junge Erkrankte mit hohem Risiko sind in Deutschland häufig sechs bis acht Zyklen R-CHOEP-14, bei dem zum R-CHOP-Schema über drei Tage zusätzlich das Medikament Etoposid (= E) gegeben wird. Die Hochdosis-Chemotherapie gefolgt von einer Transplantation autologer Blutstammzellen (= dem Patienten werden eigene, zuvor entnommene Blutstammzellen zurückübertragen) wird in der Ersttherapie junger Hochrisiko-Patienten nicht mehr empfohlen.
Selbst Patientinnen und Patienten mit relevanten Begleiterkrankungen können bis ins hohe Alter kurativ, also mit dem Ziel einer Heilung, behandelt werden. Dazu sind in Einzelfällen dann Veränderungen an dem R-CHOP-Protokoll nötig. Beispielsweise kann bei Betroffenen mit einer Vorschädigung des Herzens der Wirkstoff Doxorubicin (= H) gegen Etoposid ausgetauscht werden (= R-CEOP). Sehr alte Patienten (um 80 Jahre) lassen sich mit einer dosisreduzierten Form des Therapieprotokolls, dem sogenannten mini-R-CHOP, noch sehr gut kurativ behandeln.
Mittlerweile gibt es neben R-CHOP einige neue Medikamente, die in frühen Phasen der klinischen Prüfung ermutigende Ergebnisse erzielt haben. Hierzu gehören zum Beispiel die sogenannten kleinen Moleküle (engl. small molecules) Ibrutinib und Lenalidomid oder Copanlisib, die als Tabletten verabreicht werden und ganz gezielt Strukturen, die für das Überleben der Lymphomzellen wichtig sind, angreifen (= zielgerichtete Therapie, engl. targeted therapy). Auch wurden weitere Antikörper gegen andere Oberflächenstrukturen, wie z.B. Tafasitamab gegen CD19, entwickelt. Darüber hinaus gibt es spezialisierte Eiweißmoleküle, die entweder als Antikörper mit Brückenfunktion zum Immunsystem (sogenannte bispezifische Antikörper) oder als Chemotherapie-gekoppelte Antikörper (= ADC, antibody drug conjugates) wie das Polatuzumab Vedotin, einem anti-CD79b-Antikörper mit einem hochtoxischen synthetischen Spindelgift, zellschädigende Substanzen zielgerichtet in die DLBCL-Zelle bringen. Im Dezember 2021 wurde gerade gezeigt, dass Polatuzumab Vedotin das Vincristin in der R-CHOP-Chemotherapie bei fast gleicher Toxizität ersetzten kann (Pola-R-CHP) und dadurch ein leicht verbessertes progressionsfreies Überleben bei den Patientinnen und Patienten erzeugt wird. Eine abschließende Bewertung für die Therapielandschaft steht allerdings noch aus. Keines dieser Medikamente ist jedoch bisher für die Erstbehandlung eines diffus großzelligen B-Zell-Lymphoms zugelassen; einige dieser Substanzen werden gerade in Erstlinien-Therapieoptimierungsstudien getestet.
Die German Lymphoma Alliance e.V. (GLA) empfiehlt die Einteilung von Patienten und Patientinnen mit einem diffus großzelligen B-Zell-Lymphom in die in Tabelle 3 gezeigten prognostischen Untergruppen. Für jede dieser Subgruppen hat die GLA eine an das Risiko angepasste Studie entwickelt, in deren Rahmen Patienten behandelt werden können. Ausführliche Informationen zu allen Lymphomstudien finden sich hier: DLBCL-Studien
Stellenwert der Strahlentherapie
Die Rolle der Strahlentherapie ist wissenschaftlich noch immer nicht exakt gesichert. Sie scheint unter anderem bei großen Lymphommassen (= Bulk), bei denen nach der Chemotherapie eine partielle Remission vorliegt, einen Stellenwert zu haben.
Rezidivtherapie: Behandlung nach einem Rückfall
Die Therapie eines Rückfalls (= Rezidiv) hängt vom Alter und dem körperlichen Allgemeinzustand des Patienten bzw. der Patientin ab und davon, wie lange die krankheitsfreie Zeit angehalten hat (= Dauer der Remission). Am schwierigsten sind diffus großzellige B-Zell-Lymphome zu behandeln, die trotz einer konsequenten Erstlinientherapie größer werden (= primär progrediente
DLBCL oder auch primär refraktäre DLBCLs) oder nur sechs bis zwölf Monate nach Abschluss der Erstlinientherapie in Remission bleiben. Die Behandlung des rezidivierten DLBCL ist eine individuelle Entscheidung, die in Abhängigkeit von der Erkrankung und von Eigenschaften der erkrankten Person viele Optionen umfasst und durch hämato-onkologische Ärztinnen und
Ärzte mit grosser Erfahrung in der Behandlung von rezidivierten und refraktären Lymphomen erfolgen sollte. Auch in der rezidivierten und refraktären Situation ist das Therapieziel häufig noch die Heilung von der Erkrankung. Prinzipiell entscheiden dies jedoch Erkrankte und Behandelnde gemeinsam nach Evaluierung aller Optionen.
Zum Zeitpunkt des Erstellens dieser Information ist das Standardvorgehen in der 2. Therapielinie bei Patientinnen und Patienten, die man außerhalb von Studien kurativ behandeln will, die Gabe einer nicht-kreuzresistenten Chemotherapie mit nachfolgender Konsolidierung durch eine autologe Stammzelltransplatation. Durch den wissenschaftlichen Fortschritt und die Weiterentwicklung der DLBCL-Therapie ist der Therapiealogorithmus gegenwärtig im Wandel und neuere nicht chemotherapiebasierte Therapieverfahren, wie die sogenannten CAR-T-Zellen (= genetisch veränderte eigene T-Zellen, siehe unten) drängen in frühere Behandlungslinien. Im Dezember 2021 erschienen die ersten Daten, dass eine CAR-T-Zelltherapie
einer autologen Stammzelltransplantation bei einem Frührezidiv überlegen ist und daher zeitnah in die 2. Therapielinie vordringen wird. Der endgültige Einbau in den Therapiealgorithmus
und die Zulassung sind aber bei Erstellen dieser Information noch nicht erfolgt. Nachfolgend werden daher die gängigen Therapieverfahren einzeln vorgestellt.
Autologe oder allogene Stammzelltransplantation
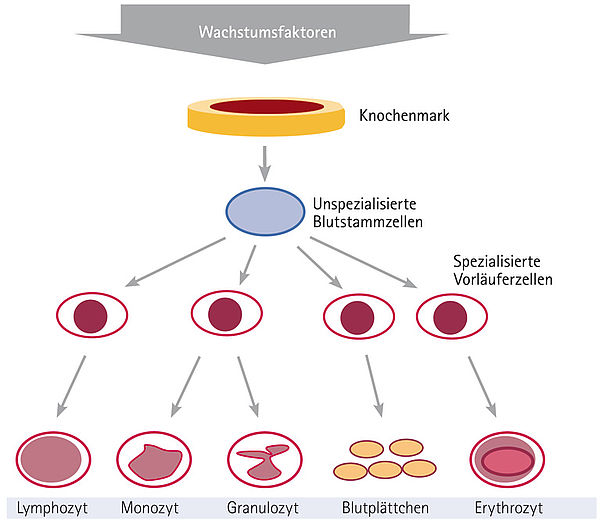
Als Stammzellen werden jene Ursprungszellen im menschlichen Körper bezeichnet, die die Fähigkeit haben, sich in unterschiedliche Zellarten weiterzuentwickeln. Menschen haben rund zwanzig verschiedene Stammzellarten, darunter die Blutstammzellen. Diese befinden sich vor allem im Knochenmark, aber auch im Blutkreislauf. Blutstammzellen können sich selbst vermehren und durch Reifung in verschiedene Blutzellarten entwickeln – also auch in Lymphozyten (siehe dazu auch die Abbildung unten).
Unterschieden wird zwischen einer autologen (Blut-)Stammzelltransplantation, bei der den Patienten und Patientinnen im Anschluss an eine Hochdosistherapie zuvor entnommene eigene Blutstammzellen zurückübertragen werden, und einer allogenen (Blut-)Stammzelltransplantation, bei der die Erkrankten nach einer Hochdosistherapie die Blutstammzellen eines geeigneten
gesunden Fremd- oder Familienspenders erhalten.
Das Alter und der körperliche Allgemeinzustand der Patientin bzw. des Patienten sind wichtig für die Beurteilung, ob eine Stammzelltransplantation durchgeführt werden kann. Bei der Übertragung von autologen Blutstammzellen gilt 75 Jahre meist als obere Altersgrenze, bei der allogenen Transplantation sind es in der Regel 65 Jahre. Die starren Altersgrenzen wurden in den letzten Jahren jedoch zunehmend aufgeweicht und inzwischen werden auf der Basis von objektivierbaren Scores und der Einschätzung erfahrener Transplanteure immer öfter individualisierte Entscheidungen getroffen. Die Entscheidung für oder gegen eine Stammzelltransplantation muss jedoch für jeden erkrankten Menschen ganz individuell getroffen werden.
Ablauf der autologen Stammzelltransplantation beim diffus großzelligen B-Zell-Lymphom
Induktion (= Einleitung): Bei Betroffenen mit einem Rezidiv eines diffus großzelligen B-Zell-Lymphoms, für die eine autologe Transplantation sinnvoll erscheint, erfolgt zunächst die Behandlung mit zwei bis drei Zyklen einer intensiven nicht-kreuzresistenten Chemotherapie, z.B. mit R-DHAP (= Rituximab, Dexamethason, hochdosiertes Ara-C und Cisplatin) oder mit R-ICE (= Rituximab, Ifosfamid, C arboplatin, Etoposid) o der R-GDP ( Rituximab, G emcitabine, Dexametason, Cisplatin). Durch diese Chemotherapie soll bereits ein Großteil der Tumorzellen zerstört werden. Da durch diese Behandlung aber auch viele gesunde weiße Blutzellen vernichtet werden, beginnt das blutbildende System damit, vermehrt Stammzellen zu produzieren, aus denen neue
weiße Blutzellen heranreifen können. Der überwiegende Teil dieser Stammzellen befindet sich im Knochenmark, einige Stammzellen zirkulieren jedoch auch im Blutkreislauf. Durch die Gabe von Wachstumsfaktoren (G-CSF) kann die Anzahl der Stammzellen im Blut erhöht werden.
Stammzellapherese (= Sammlung von Blutstammzellen): Befinden sich im Blut genügend Stammzellen, wird die am DLBCL erkrankte Person an eine Apherese-Maschine angeschlossen. Sie filtert die Stammzellen aus dem Blut heraus und gibt alle nicht benötigten Blutzellen wieder in den Blutkreislauf zurück. Dieser drei- bis fünfstündige Vorgang kann ambulant durchgeführt werden. Er wird so oft wiederholt, bis genügend Stammzellen vorhanden sind. Die gewonnenen Stammzellen werden bis zur Übertragung in flüssigem Stickstoff bei minus 196 Grad Celsius eingefroren. Befinden sich im Blut genügend Stammzellen, wird der Patient an eine Apherese-Maschine angeschlossen. Sie filtert die Stammzellen aus dem Blut heraus und gibt alle nicht benötigten Blutzellen wieder in den Blutkreislauf zurück. Dieser drei- bis fünfstündige Vorgang kann ambulant durchgeführt werden. Er wird so oft wiederholt, bis genügend Stammzellen vorhanden sind. Die gewonnenen Stammzellen werden bis zur Übertragung in flüssigem Stickstoff bei minus 196 Grad Celsius eingefroren.
Konditionierung (= Hochdosis-Therapie): Nachdem genügend Stammzellen gewonnen wurden, wird eine eine weitere, sogenannte „myeloablative“ (gr. myelo- = Mark; ablativ = abtragend) Chemotherapie durchgeführt. Dazu wird häufig das BEAM-Schema, bestehend aus BCNU, Etoposid, Ara-C und Melphalan angewendet. Die myeloablative Chemotherapie hat das Ziel, die restlichen Tumorzellen zu vernichten und ist so stark dosiert, dass auch das Knochenmark der behandelten Person zerstört wird. In manchen Fällen wird die Hochdosistherapie auch mit einer Ganzkörperbestrahlung kombiniert.Nachdem genügend Stammzellen gewonnen wurden, erhält der Patient eine weitere, sogenannte „myeloablative“ (gr. myelo- = Mark; ablativ = abtragend) Chemotherapie. Dazu wird häufig das BEAM-Schema, bestehend aus BCNU, Etoposid, Ara-C und Melphalan angewendet. Die myeloablative Chemotherapie hat das Ziel, die restlichen Tumorzellen zu zerstören und ist so stark dosiert, dass auch das Knochenmark des Patienten zerstört wird. In manchen Fällen wird die Hochdosistherapie auch mit einer Ganzkörperbestrahlung kombiniert.
Transplantation (= Übertragung der Blutstammzellen): Rund zwei Tage nach der Konditionierung werden die zuvor aufgetauten Blutstammzellen mittels einer Transfusion in die Vene zurückübertragen. Sie wandern eigenständig in das Knochenmark des Patienten bzw. der Patientin. Dort beginnen sie nach ca. 10 Tagen sich wieder zu teilen und weiße und rote Blutkörperchen sowie Blutplättchen zu produzieren. Zwei bis drei Wochen nach einer solchen autologen Transplantation kann die so behandelte Person nach Hause entlassen werden. Rund zwei Tage nach der Konditionierung werden dem Patienten die zuvor aufgetauten Blutstammzellen mittels einer Transfusion in die Vene zurückübertragen. Sie wandern eigenständig in das Knochenmark des Patienten. Dort beginnen sie nach ca. 10 Tagen sich wieder zu teilen und weiße und rote Blutkörperchen sowie Blutplättchen zu produzieren. Zwei bis drei Wochen nach einer solchen autologen Transplantation kann der Patient nach Hause entlassen werden.
Allogene Stammzellentransplantation beim diffus großzelligen B-Zell-Lymphom
Bei einer allogenen Stammzelltransplantation werden Blutstammzellen übertragen, die eine verwandte oder nichtverwandte Person spendet. Voraussetzung ist allerdings, dass diese Person in den wesentlichen Gewebemerkmalen mit denen des Erkrankten übereinstimmt. Zu diesem Zweck werden deutschlandweit, notfalls auch weltweit Knochenmarkspenderregister durchsucht.
Der Ablauf einer allogenen Transplantation erfolgt ähnlich dem einer autologen: Hierbei werden der Spenderin oder dem Spender die Stammzellen nach Stimulation mit dem Wachstumshormon G-CSF durch eine Apherese entnommen. Nur selten gewinnt man die Stammzellen aus dem Knochenmark des Beckenkamms (z.B. wenn die spendende Person die Stimulation mit G-CSF
ablehnt). Die allogenen Stammzellen werden im Allgemeinen nicht eingefroren, sondern der am DLBCL erkrankten Person ungefähr zwei Tage nach Abschluss der Konditionierungstherapie übertragen. Dies erfordert eine gute Koordination zwischen dem Transplantationszentrum und dem Zentrum, das die Stammzellen entnimmt. Dies gilt insbesondere bei Fremdtransplantationen
mit nicht-verwandten Personen, da Entnahme- und Transplantationszentrum mitunter tausende Kilometer voneinander entfernt sein können.
Wer die Stammzellen erhält, wird zusätzlich zu einer myeloablativen Chemotherapie mit einer immunsuppressiven Therapie behandelt. Diese unterdrückt das eigene Immunsystem und verhindert, dass eventuell noch vorhandene Immunzellen der erkrankten Person die neu empfangenen Stammzellen nach der Transplantation angreifen (HvGR = Host-versus-Graft-Reaktion). Andererseits muss nach Transplantation verhindert werden, dass das neu übertragene Immunsystem gegen die Zellen des Empfängers reagiert. Dies geschieht durch eine weitere immunsuppressive Therapie, die meistens 100 Tage nach der Transplantation beendet werden kann. Diese mögliche Komplikation wird auch als „Graft-versus-Host-Reaktion“ (= GvHR) oder „Transplantat-gegen-Wirt-Reaktion“ bezeichnet.
Die Wirksamkeit der allogenen Transplantation – trotz fehlendem Ansprechen auf die Chemotherapie in vorangegangenen Therapielinien – beruht vor allem auf dem immuntherapeutischen Effekt, den das neue, übertragene Immunsystem für den erkrankten Menschen hat. Denn im Gegensatz zur Situation nach einer autologen Transplantation erkennt das übertragene Immunsystem die Lymphomzellen der am DLBCL erkrankten Person als fremd und greift sie an. Diese Wirkung wird auch als „Graft-versus-Lymphom-Reaktion“ (= GvLR) bezeichnet und ist von der oben genannten Abstoßungsreaktion (= Graft-versus-Host-Reaktion, GvHR) nicht gänzlich zu trennen: Bemerkenswert ist, dass Patientinnen und Patienten, die eine Graft-versus-Host-Reaktion erfahren, ein niedrigeres Risiko für einen weiteren Rückfall haben, als jene, die diese nicht bekommen. Insofern ist eine geringgradige, d.h. gut zu behandelnde Graft-versus-Host-Reaktion durchaus erwünscht. Die allogene Transplantation ist zum Zeitpunkt des Erstellung dieser Information zunehmend in den Hintergrund gerückt, stellt aber weiter eine echte Therapieoption nach Versagen vorheriger Therapielinien dar.
CAR-T-Zell-Therapie
Eine weitere neue Therapie für Patientinnen und Patienten im Rückfall ist die sogenannte CAR-T-Zell-Therapie. Bei dieser Therapie werden der am DLBCL erkrankten Person T-Lymphozyten aus dem Blut entnommen. Diese Zellen werden an ein Herstellerlabor geschickt und gentechnisch so verändert, dass ein künstlicher Rezeptor eingebaut wird, der das bei Lymphomen häufige
Antigen CD19 erkennt. Diese Zellen werden zur Vermehrung angeregt und dann mit Hilfe einer Infusion in die Blutbahn der Patientin oder des Patienten zurückgegeben. Durch den Kontakt der CAR-T-Zellen mit den Lymphomzellen werden die Lymphomzellen abgetötet. Diese Therapie ist bei erwachsenen Menschen mit rezidiviertem oder refraktärem DLBCL und primär mediastinalem großzelligem B-Zell-Lymphom (PMBCL) nach zwei oder mehr systemischen Therapien zugelassen. Praktisch bedeutet dies, dass bei Menschen, die auf die genannten Chemotherapien im Rezidiv nicht angesprochen haben, geprüft wird, ob Sie für eine CAR-T-Zell-Therapie in Betracht kommen. Da der Herstellungsprozess gegenwärtig noch ca. 3 Wochen Zeit in Anspruch nimmt, wird in dieser Zeit eine sogenannte Brückentherapie appliziert. Das Finden optimaler Brückentherapien ist Gegenstand der Forschung. Gegenwärtig werden Polatuzumb-basierte Therapien oder Tafasitamb/Lenalidomib sowie Gemcitabine/Oxaliplatin dazu verwendet (siehe auch unter nicht-kurative Salvage-Therapien). Anders als allogene Stammzelltransplantationen sind CAR-T-Zell-Therapien aus medizinischer Sicht einem größeren Patientenkreis zugänglich. Ausführliche Informationen zu diesem zellulären Therapieverfahren
finden Sie hier: CAR-T-Zell-Therapien
Nicht-kurative Salvage-Therapien
Von einem DLBCL-Rezidiv Betroffene, für die weder eine CAR-T-Zell-Therapie noch eine Stammzelltransplantation in Betracht kommt, können bei einem Rezidiv eine sogenannte Salvage-Therapie (engl. salvage = Rettung) erhalten. Das am häufigsten eingesetzte Schema ist Pola-BR (Polatuzumab-Vedotin, ein monoklonaler Antikörper gegen CD79b gekoppelt mit einem Spindelgift, plus Bendamustin-Rituximab) und/oder Tafasitamab (ein anti-CD19-Antikörper) plus Lenalidomid. Obwohl ein direkter Vergleich dieser Therapieformen bisher nicht vorliegt, erzielen Tafasitamab/Lenalidomid und Polatuzumab-BR bessere Langzeitdaten, als das früher häufig eingesetzte GemOx-Schema (eine Kombination aus Gemcitabin und Oxaliplatin). Bei Versagen dieser Therapien können erneut rezidivierende Patientinnen und Patienten entweder im Rahmen einer prospektiven Studie mit neuen Medikamenten behandeln werden oder sie erhalten eine palliative Therapie mit dem Ziel, das Fortschreiten der Erkrankung zu verlangsamen und die Symptome zu reduzieren.
Alternative oder komplementäre Behandlungsmethoden
An Krebs erkrankte Menschen haben häufig den Wunsch, neben der Behandlung selbst etwas für ihre Gesundheit tun zu können. Manchmal suchen sie oder ihre Angehörigen nach „sanften" oder „natürlichen" Wirkstoffen und Methoden, die – ohne Nebenwirkungen zu verursachen – die Krankheit bekämpfen können. Auch gibt es in den Medien immer wieder Hinweise auf
sogenannte „Wundermittel" – seien es Vitamine oder andere pflanzliche Präparate – die besser als jede Schulmedizin den Krebs besiegen könnten. Sie wecken leider nicht erfüllbare Hoffnungen bei Erkrankten und ihren Angehörigen und müssen oft teuer bezahlt werden. Keine der sogenannten alternativen Behandlungsmethoden konnte bisher in kontrollierten Studien eine Wirksamkeit beim diffus großzelligen B-Zell-Lymphom nachweisen.
Als komplementäre Therapien gelten Substanzen oder Methoden, die ergänzend zu den oben beschriebenen Standardtherapien eingenommen oder angewendet werden. Auch bei den komplementären Therapien ist Vorsicht geboten, da nicht ausgeschlossen werden kann, dass es zwischen diesen und der Standardtherapie zu Wechselwirkungen kommt. Einige können den Patientinnen und Patienten direkt schaden, weil sie zum Beispiel die Nebenwirkungen der Standardtherapie erhöhen oder ihre Wirkung abschwächen könnten. Sie sollten ihren Arzt daher grundsätzlich über alle Medikamente und Substanzen informieren, die Sie zusätzlich zu den von Ihrem Arzt oder Ihrer Ärztin verschriebenen einnehmen wollen.
Eine wichtige ergänzende Therapie stellt hier die Gabe von Vitamin D dar. Untersuchungen haben gezeigt, dass zu geringe Vitamin-D-Spiegel die Wirksamkeit des monoklonalen Antikörpers Rituximab abschwächen. Deshalb sollte bei einem niedrigen Vitamin-D-Spiegel eine Vitamin-D-Substitution erfolgen, sodass der Vitamin-D-Serumspiegel im mittleren Normalbereich liegt.
Grundsätzlich sollten sich Erkrankte vor und während der Immunchemotherapie körperlich fit halten und gesund ernähren. In großen Studien wurde gezeigt, dass Lymphom-Patientinnen und -Patienten, die sich einem konsequenten Sportprogramm mit Kraft- und Ausdauersport unterziehen, eine höhere Heilungsrate haben.
