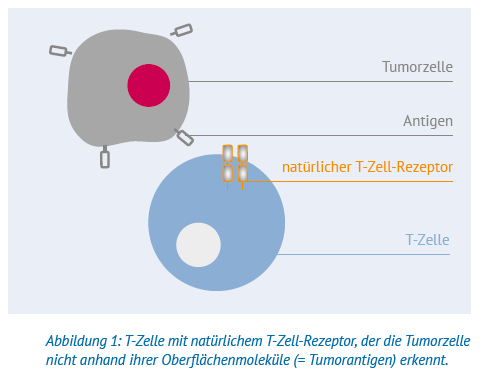
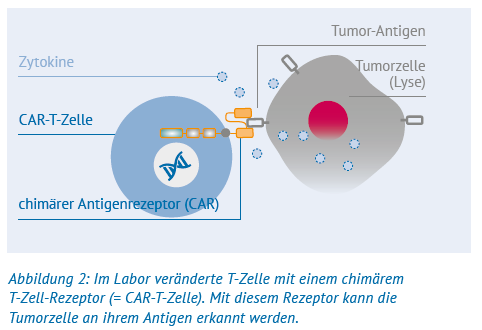
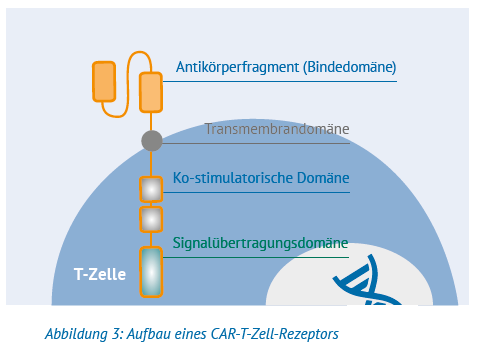
Als Stammzellen werden jene Ursprungszellen im menschlichen Körper bezeichnet, die die Fähigkeit haben, sich in unterschiedliche Zellarten weiterzuentwickeln. Menschen haben rund zwanzig verschiedene Stammzellarten, darunter die Blutstammzellen. Diese befinden sich vor allem im Knochenmark, aber auch im Blutkreislauf. Blutstammzellen können sich selbst vermehren und durch Reifung in verschiedene Blutzellarten entwickeln – also auch in Lymphozyten (siehe dazu auch die Abbildung unten).
Blutbildung aus Stammzellen
Unterschieden wird zwischen einer autologen (Blut-)Stammzelltransplantation, bei der dem Patienten im Anschluss an eine Hochdosistherapie zuvor entnommene eigene Blutstammzellen zurückübertragen werden, und einer allogenen (Blut-) Stammzelltransplantation, bei der ein Patient nach einer Hochdosistherapie die Blutstammzellen eines geeigneten gesunden Fremd- oder Familienspenders erhält.
Das Alter und der körperliche Allgemeinzustand des Patienten sind wichtig für die Beurteilung, ob eine Stammzelltransplantation durchgeführt werden kann. Bei der Übertragung von autologen Blutstammzellen gilt 75 Jahre meist als obere Altersgrenze, bei der allogenen Transplantation sind es in der Regel 65 Jahre. Die Entscheidung für oder gegen eine Stammzelltransplantation muss jedoch für jeden Patienten ganz individuell getroffen werden und wird nicht nur vom Alter vorgegeben.
Ablauf der autologen Stammzelltransplantation
- Induktion (= Einleitung): Bei Patienten mit dem Rezidiv eines diffus großzelligen B-Zell-Lymphoms, für die eine autologe Transplantation sinnvoll erscheint, erfolgt zunächst die Behandlung mit zwei bis drei Zyklen einer intensiven Chemotherapie, z.B. mit DHAP (= Dexamethason, hochdosiertes Ara-C und Cisplatin) oder mit ICE (= Ifosfamid, Carboplatin, Etoposid). Durch diese Chemotherapie soll bereits ein Großteil der Tumorzellen zerstört werden. Da durch diese Behandlung aber auch viele gesunde weiße Blutzellen vernichtet werden, beginnt das blutbildende System des Patienten damit, vermehrt Stammzellen zu produzieren, aus denen neue weiße Blutzellen heranreifen können. Der überwiegende Teil dieser Stammzellen befindet sich im Knochenmark, einige Stammzellen zirkulieren jedoch auch im Blutkreislauf. Durch die Gabe von Wachstumsfaktoren (G-CSF) kann die Anzahl der Stammzellen im Blut erhöht werden.
- Stammzellapherese (= Sammlung von Blutstammzellen): Befinden sich im Blut genügend Stammzellen, wird der Patient an eine Apherese-Maschine angeschlossen. Sie filtert die Stammzellen aus dem Blut heraus und gibt alle nicht benötigten Blutzellen wieder in den Blutkreislauf zurück. Dieser drei- bis fünfstündige Vorgang kann ambulant durchgeführt werden. Er wird so oft wiederholt, bis genügend Stammzellen vorhanden sind. Die gewonnenen Stammzellen werden bis zur Übertragung in flüssigem Stickstoff bei minus 196 Grad Celsius eingefroren.
- Konditionierung (= Hochdosis-Therapie): Nachdem genügend Stammzellen gewonnen wurden, erhält der Patient eine weitere, sogenannte „myeloablative“ (gr. myelo- = Mark; ablativ = abtragend) Chemotherapie. Dazu wird häufig das BEAM-Schema, bestehend aus BCNU, Etoposid, Ara-C und Melphalan angewendet. Die myeloablative Chemotherapie hat das Ziel, die restlichen Tumorzellen zu zerstören und ist so stark dosiert, dass auch das Knochenmark des Patienten zerstört wird. In manchen Fällen wird die Hochdosistherapie auch mit einer Ganzkörperbestrahlung kombiniert.
- Transplantation (= Übertragung der Blutstammzellen): Rund zwei Tage nach der Konditionierung werden dem Patienten die zuvor aufgetauten Blutstammzellen mittels einer Transfusion in die Vene zurückübertragen. Sie wandern eigenständig in das Knochenmark des Patienten. Dort beginnen sie nach ca. 10 Tagen sich wieder zu teilen und weiße und rote Blutkörperchen sowie Blutplättchen zu produzieren. Zwei bis drei Wochen nach einer solchen autologen Transplantation kann der Patient nach Hause entlassen werden.
Allogene Stammzelltransplantation
Bei der allogenen Stammzelltransplantation werden Blutstammzellen von einem verwandten oder nichtverwandten Spender übertragen. Voraussetzung ist allerdings, dass man einen geeigneten Spender findet, der in den wesentlichen Gewebemerkmalen mit denen des Patienten übereinstimmt. Zu diesem Zweck werden deutschlandweit, notfalls auch weltweit Knochenmarkspenderregister durchsucht.
Der Ablauf einer allogenen Transplantation erfolgt ähnlich dem einer autologen: Hierbei werden dem Spender die Stammzellen nach Stimulation mit dem Wachstumshormon G-CSF durch eine Apherese entnommen. Nur selten gewinnt man die Stammzellen aus dem Knochenmark des Beckenkamms (z.B. wenn der Spender die Stimulation mit G-CSF ablehnt). Die allogenen Stammzellen werden im Allgemeinen nicht eingefroren, sondern dem Patienten ungefähr zwei Tage nach Abschluss der Konditionierungstherapie übertragen. Dies erfordert eine gute Koordination zwischen dem Transplantationszentrum und dem Zentrum, das die Stammzellen entnimmt. Dies gilt insbesondere bei Fremdtransplantationen mit einem nicht-verwandten Spender, da Entnahme- und Transplantationszentrum mitunter tausende Kilometer voneinander entfernt sein können.
Der Empfänger wird zusätzlich zu einer myeloablativen Chemotherapie mit einer immunsuppressiven Therapie behandelt. Diese unterdrückt das eigene Immunsystem und verhindert, dass eventuell noch vorhandene Immunzellen des Patienten die Stammzellen des Spenders nach der Transplantation angreifen (HvGR = Host-versus-Graft-Reaktion). Andererseits muss nach Transplantation verhindert werden, dass das neu übertragene Immunsystem gegen die Zellen des Empfän-gers reagiert. Dies geschieht durch eine weitere immunsuppressive Therapie, die meistens 100 Tage nach der Transplantation beendet werden kann. Diese mögliche Komplikation wird auch als „Graft-versus-Host-Reaktion“ (= GvHR) oder „Transplantat-gegen-Wirt-Reaktion“ bezeichnet.
Die bessere Wirksamkeit der allogenen Transplantation beruht vor allem auf dem immuntherapeutischen Effekt, den das neue, übertragene Immunsystem für den Patienten hat. Denn im Gegensatz zur Situation nach einer autologen Transplantation erkennt das übertragene Immunsystem die Lymphomzellen des Patienten als fremd und greift sie an. Diese Wirkung wird auch als „Graft-versus-Lymphom-Reaktion“ (= GvLR) bezeichnet und ist von der oben genannten Abstoßungsreaktion (= Graft-versus-Host-Reaktion, GvHR) nicht gänzlich zu trennen: Bemerkenswert ist, dass Patienten, die eine Graft-versus-Host-Reaktion erfahren, ein niedrigeres Risiko für einen weiteren Rückfall haben, als jene Patienten, die diese nicht bekommen. Insofern ist eine geringgradige, d.h. gut zu behandelnde, Graft-versus-Host-Reaktion durchaus erwünscht.