6. CAR-T-Zell-Therapie
Eine neue Therapie für Patienten im Rückfall ist die sogenannte CAR-T-Zell-Therapie. Bei dieser Therapie werden dem Patienten sogenannte T-Zellen aus dem Blut entnommen. Diese Zellen werden an ein Herstellerlabor geschickt und gentechnisch so verändert, dass ein künstlicher Rezeptor eingebaut wird, der das bei Lymphomen häufige Antigen CD19 erkennt. Diese Zellen werden zur Vermehrung angeregt und dann dem Patienten mit Hilfe einer Infusion zurückgegeben. Durch den Kontakt der CAR-T-Zellen mit den Lymphomzellen werden die Lymphomzellen abgetötet. Diese Therapie ist bei erwachsenen Patienten mit rezidiviertem oder refraktärem diffus großzelligem B-Zell-Lymphom (DLBCL) und primär mediastinalem großzelligem B-Zell-Lymphom (PMBCL) nach zwei oder mehr systemischenTherapien zugelassen.
Was sind CAR-T-Zellen und was ist das Besondere an diesem Therapieprinzip?
Die CAR-T-Zell-Therapie ist eine Behandlungsmethode, die 2018 in Europa erstmals für die Behandlung von Patientinnen und Patienten mit B-Zell-Lymphomen und B-Zell-Leukämien zugelassen wurde. Im Zentrum dieses Verfahrens stehen körpereigene Immunzellen – sogenannte T-Zellen. Diese werden aus dem Blut der erkrankten Person entnommen und anschließend in einem Speziallabor gentechnisch verändert. Die veränderten, nun als CAR-T-Zellen bezeichneten Immunzellen werden anschließend über die Vene in den Körper zurückgegeben. Sie sind in der Lage, bestimmte Krebszellen zu erkennen und abzutöten. Das Verfahren ist recht aufwendig, kann aber bei bestimmten Lymphomen, die auf eine Chemo- oder Strahlentherapie nicht Ansprechen, komplette und dauerhafte Krankheitsrückbildungen (Remissionen) bewirken.
CAR-T-Zellen nutzen unser eigenes Immunsystem bei dem Versuch, Leukämie- und Lymphomzellen zu vernichten
Lymphozyten sind weiße Blutzellen, die unser Körper produziert, um Infektionen und Erkrankungen, darunter auch Krebs, zu bekämpfen. Sie sind Teil unseres Immunsystems. Bei den Lymphozyten unterscheidet man zwischen T-Lymphozyten (T-Zellen) und B-Lymphozyten (B-Zellen). Sie haben in unserem Immunsystem unterschiedliche Aufgaben.
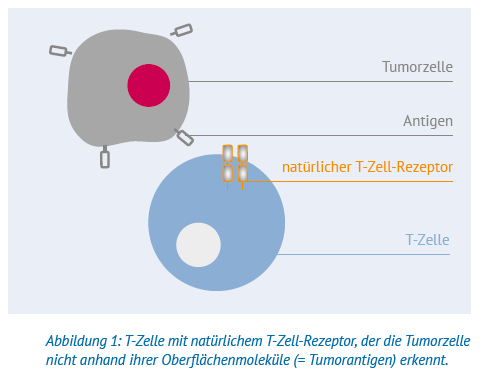
Normalerweise erkennt das Immunsystem, wenn sich eine Körperzelle fehlerhaft entwickelt. Diese wird dann aufgrund ihrer Oberflächenmerkmale (= Tumorantigene) von T-Zellen als verändert bzw. als »fremd« erkannt und von Zellen des Immunsystems zerstört. Wenn Menschen an einem Lymphom erkranken, bedeutet das, dass ihr Immunsystem die Lymphomzellen als » nicht-fremd« erkennt. Das hat auch damit zu tun, dass einige Krebszellen Wege entwickeln, sich zu tarnen. Zum Beispiel bilden Lymphomzellen auf ihren Oberflächen bestimmte Proteine, die dazu führen, dass T-Zellen diese nicht von körpereigenen Zellen unterscheiden können und daher nicht angreifen. Die Erkennung von »fremd« oder »nicht-fremd« erfolgt über Strukturen auf den von T-Zellen, den sogenannten T-Zell-Rezeptoren.
Bei der CAR-T-Zell-Therapie werden T-Zellen eines Patienten gesammelt und in einem Labor gentechnisch verändert. Im Wesentlichen werden den vorhandenen T-Zell-Rezeptoren Teile eines Antikörpers hinzugefügt. Dadurch werden die T-Zellen in die Lage versetzt, die zuvor nicht bemerkten Krebszellen anhand ihrer Oberflächenstruktur als »fremd« zu erkennen und abzutöten. Da dieser neue Rezeptor eine künstliche Mischung aus dem natürlichen T-Zell-Rezeptor und einem Antikörper ist, wird er nach den Mischwesen (= Chimären) der altgriechischen Götter- und Heldendichtung als »chimärer Antigenrezeptor« (abgekürzt = CAR) bezeichnet. Die gentechnisch veränderten T-Zellen werden in »CART-Zellen« umbenannt.
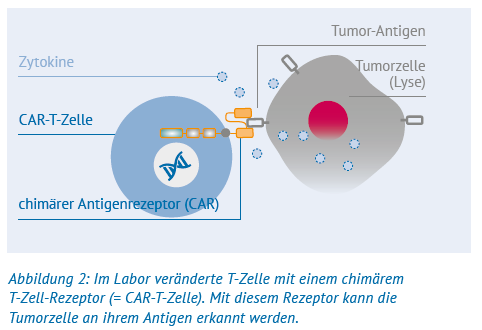
Danach werden die CAR-T-Zellen im Labor vermehrt, bis ihre Anzahl hoch genug ist, das Lymphom zu behandeln. Schließlich werden sie dem Patienten wie bei einer Bluttransfusion über den zentralen Venenkatheter oder die Armvene zugeführt.
Aufbau einer CAR-T-Zelle
Bei der gentechnischen Herstellung von CAR-T-Zellen wird im Labor ein »chimärer Antigenrezeptor« (= CAR) an die entnommenen T-Zellen gebunden. Der CAR besteht aus mehreren Teilen, die oft auch als Domänen bezeichnet werden. Dazu gehören normalerweise:
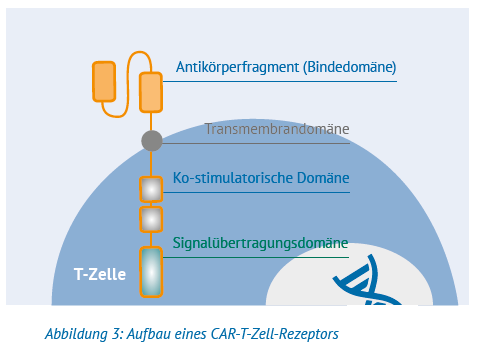
- Ein Antigenrezeptor, das ist jener Teil, der sich als Bindedomäne außerhalb der T-Zelle befindet und mit einem bestimmten Ziel auf den Krebszellen verbinden soll.
- Mit der Transmembrandomäne wird die Bindedomäne samt Antikörperfragment auf der Oberfläche der T-Zellen verankert.
- Wichtig für die therapeutische Aktivität sind die Signaldomänen. Sie liefern Stimulations- und Aktivierungssignale, die die CAR-T-Zellen darin unterstützen, sich zu vermehren und im Körper des Patienten zu überleben.
Sobald eine CAR-T-Zelle an eine Krebszelle bindet, sendet sie Signale (= Zytokine), die das Immunsystem dazu bringen, die Krebszelle zu zerstören. Es gibt verschiedene CAR-T-Zell-Produkte, die sich grundsätzlich darin unterscheiden, auf welche Zielstrukturen der Antigenrezeptor ausgerichtet ist. Bei Leukämien und Lymphomen stellt der Oberflächenmarker CD19 eine solche Zielstruktur dar. Es sind weitere CAR-T-Zell-Produkte in der Entwicklung, die auch an andere Oberflächenstrukturen binden können, zum Beispiel an das »B-cell maturation antigen« (BCMAL), das auf Zellen des Multiplen Myeloms vorkommt. Darüber hinaus unterscheiden sich die CAR-T-Zellen in den Signaldomänen. Beispielsweise sind neue CAR-T-Zellen in der Entwicklung, denen Teile hinzugefügt wurden, damit sie ausgeschaltet werden können, wenn sie Probleme im Körper verursachen.
Wer kann mit CAR-T-Zellen behandelt werden?
In Europa wurden bislang zwei kommerzielle Produkte der CAR-T-Zell-Therapie für erwachsene Patientinnen und Patienten mit aggressiven, schnell wachsenden Lymphomen zugelassen (Stand: 10/2020):
- Tisagenlecleucel (Kymriah©) für Erkrankte mit einem diffus großzelligen B-Zell-Lymphom (DLBCL), die zwei oder mehr Vortherapien erhalten hatten, deren Lymphom jedoch nicht auf die Behandlung ansprach (= refraktär) oder deren Lymphom zurückkam (= rezidiviert).
- Axicabtagene Ciloleucel (Yescarta©) für Patientinnen und Patienten mit rezidiviertem oder refraktärem DLBCL oder primär mediastinalem großzelligen B-Zell-Lymphom (PMBL) nach zwei oder mehr Vorbehandlungen. Für diese und andere Lymphomerkrankungen werden weitere CAR-T-Zell-Produkte in klinischen Studien getestet.
Die CAR-T-Zell-Therapie ist eine intensive Behandlungsart und die Patientinnen und Patienten müssen grundsätzlich fit genug sein, damit sie mit CAR-T-Zellen behandelt werden können. Doch selbst wenn Patienten für diese Behandlung geeignet sind, ist die Behandlung manchmal aus mehreren Gründen nicht möglich:
- Möglicherweise können nicht genügend T-Zellen gesammelt werden, um CAR-T-Zellen herzustellen
- Das Labor kann die Herstellung möglicherweise nicht erfolgreich durchführen
- CAR-T-Zellen müssen für jeden Menschen individuell hergestellt werden, ein Prozess, der mehrere Wochen dauern kann. Es kann passieren, dass sich die Erkrankung zwischenzeitlich so verschlechtert, dass die Patientin oder der Patient möglicherweise nicht fit genug sind, um die Therapie zu erhalten.
Wie wird eine CAR-T-Zell-Therapie durchgeführt?
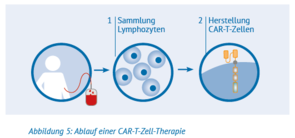
Schritt 1: Sammlung der Lymphozyten
Nach einer Reihe von Voruntersuchungen werden zu Beginn Lymphozyten aus dem Blut des Patienten entnommen. Dieser Sammelprozess wird »Leukapherese« genannt. Bei der Leukapherese wird das Blut mit einer dünnen Nadel aus
dem Arm entnommen und über einen Schlauch in einen Zellseparator geleitet. Diese Maschine trennt die Lymphozyten (T-Zellen und weitere Lymphozyten) von anderen Blutbestandteilen und sammelt sie. Der Rest des Blutes wird über eine andere Leitung in den Blutkreislauf des Patienten zurückgeführt. Durch die Leukapherese werden nur die im Blut schwimmenden Lymphozyten gesammelt, andere Lymphozyten verbleiben im Körper.
Schritt 2: Herstellung der CAR-T-Zellen
Im Labor werden die T-Zellen dann gentechnisch bearbeitet und können sich vermehren, bis genügend Zellen vorhanden sind, um die Behandlung wirksam zu machen. Es wird eine hinreichend große Anzahl von CAR-T-Zellen benötigt, damit diese im Körper des Patienten überleben und die meisten oder alle Lymphomzellen zerstören können. Die Herstellung und Vermehrung der CAR-T-Zellen ist kompliziert und dauert etwa 14 Tage. Allerdings kann sich die Zeit zwischen der Zellsammlung und der Rückgabe der modifizierten
Zellen auf bis zu 4-5 Wochen ausdehnen. Dies hängt wesentlich davon ab, wo die Zellen modifiziert werden und ob sie frisch verarbeitet oder vor und nach dem Produktionsprozess in flüssigem Stickstoff haltbar gemacht (= kryokonserviert) werden müssen.
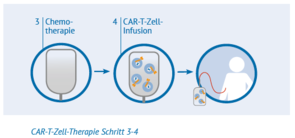
Schritt 3: Chemotherapie
Wenn die CAR-T-Zellen erfolgreich hergestellt wurden und die Patienten fit sind, erhalten sie zunächst über einige Tage eine vorbereitende Chemotherapie. Dadurch soll die Menge der weißen Blutzellen im Körper verringert und Platz geschaffen werden, damit sich die CAR-T-Zellen ungehindert vermehren können.
Schritt 4: Infusion der CAR-T-Zellen
Die CAR-T-Zellen werden intravenös – also über die Vene – in den Patienten gegeben. Dies kann entweder über die die Armvene oder über einen zentralen Venenkatheter erfolgen. Normalerweise erhalten Patienten nur eine CAR-T-Zell-Infusion. Diese sollte genügend Zellen enthalten, um das Lymphom wirksam zu behandeln. Vor, während und nach der Behandlung werden die Patienten im Behandlungszentrum sorgfältig überwacht, damit Ärzte im Falle von Nebenwirkungen schnell reagieren können.
Wirksamkeit der Behandlung mit CAR-T-Zellen
Die CAR-T-Zell-Therapie ist eine neue Behandlungsmethode, daher ist noch wenig über ihre Langzeitwirkung bekannt oder darüber, wie lange das Lymphom auf die Behandlung anspricht. Erste Ergebnisse aus klinischen Studien sind sehr ermutigend, insbesondere für Menschen, die nach den Vorbehandlungen nur wenige andere Behandlungsmöglichkeiten haben.
Axicabtagene Ciloleucel
Bei etwa drei Viertel von 101 Patienten, die mit Axicabtagene Ciloleucel in einer klinischen Studie behandelt wurden, war die Behandlung wirksam. Insgesamt vier von zehn Patienten hatten eine komplette Remission, das heißt, das Lymphom wurde vollständig beseitigt. Patienten die vollständig auf die Behandlung angesprochen hatten, blieben eher in Remission (kein Hinweis auf ein Lymphom feststellbar). Patienten, die an der Studie teilgenommen hatten, waren entweder an einem DLBCL oder einem PMBL erkrankt, darunter DLBCL, die sich als Transformation eines follikulären Lymphoms entwickelt hatten, Patienten mit double-hit oder triple-hit DLBCL und Patienten mit nicht näher spezifizierten aggressiven B-Zell-Lymphomen. Alle Studienteilnehmer hatten Vortherapien erhalten und ihr Lymphom hatte entweder nicht angesprochen oder sie erlitten nach wenigstens zwei Behandlungsregimen ein Rezidiv.
Tisagenlecleucel
Etwa die Hälfte von 111 Personen, die in einer klinischen Studie mit Tisagenlecleucel behandelt wurden, sprachen auf die Behandlung an, wobei insgesamt vier von zehn Behandelten eine komplette Remission hatten. Ebenso wie Axicabtagene Ciloleucel scheint das Ansprechen auf Tisagenlecleucel bei denen, die vollständig ansprachen, von Dauer zu sein. Die in diese Studie einbezogenen Patienten hatten alle DLBCL (einschließlich DLBCL, die sich aus einem follikulären Lymphom transformiert hatten) und alle hatten wenigstens zwei Vortherapien erhalten.
Sind CAR-T-Zellen in Deutschland verfügbar?
Axicabtagene Ciloleucel und Tisagenlecleucel sind in Deutschland zugelassen und die Kosten der Behandlung werden von den Krankenkassen übernommen. CAR-T-Zell-Therapien können nur in spezialisierten Behandlungszentren sicher angewendet werden, die über besonders geschultes Personal verfügen. Daher könnte es sein, dass Sie für eine CAR-T-Zell-Therapie an ein anderes Behandlungszentrum überwiesen werden müssen. Derzeit behandeln 27 deutsche Universitätskliniken Patienten mit CAR-T-Zell-Therapien. Eine aktuelle Liste der CAR-T-Zell-Zentren in Deutschland ist über die Expertensuche möglich.
Mögliche Nebenwirkungen
Alle Arzneimittel können als Nebenwirkungen unerwünschte Reaktionen hervorrufen – an dieser Stelle können nur die wichtigsten Nebenwirkungen dargestellt werden. Da die CART-Zell-Therapie eine relativ neue Art der Behandlung ist, werden weiterhin Informationen über mögliche Nebenwirkungen gesammelt – fragen Sie gegebenenfalls Ihr medizinisches Team nach aktuellen Informationen. Bevor Patientinnen und Patienten mit einer CAR-T-Zell-Therapie beginnen, sollten sie mit ihren Ärzten auch über mögliche Begleiterkrankungen sprechen und alle Medikamente und Nahrungsergänzungsmittel erwähnen, die sie einnehmen.
CAR-T-Zellen können bei einigen Menschen schwerwiegende Nebenwirkungen verursachen, so dass die Behandlung nur in Einrichtungen durchgeführt wird, die hinsichtlich ihrer Ausstattung und ihres Personals alle Voraussetzungen erfüllen, um auftretende Nebenwirkungen gut behandeln zu können. Darüber hinaus erhalten Patientinnen und Patienten vor der Infusion der CAR-T-Zellen vorbeugende Medikamente (z.B. Paracetamol und Antihistaminika). Nach der CAR-T-Zell-Infusion werden Patienten etwa zwei Wochen lang stationär im Behandlungszentrum überwacht. Auch nach ihrer Entlassung sollten sie für weitere zwei Wochen selbst auf Symptome achten und ihr Behandlungsteam sofort benachrichtigen, wenn sich ihr Gesundheitszustand ändert.
Häufige Nebenwirkungen von CAR-T-Zellen, die bei mehr als einem von fünf Personen auftreten, sind:
- Zytokinfreisetzungssyndrom
- Fieber und Schüttelfrost
- Niedriger Blutdruck und niedriger Sauerstoffgehalt
- Probleme mit dem Nervensystem einschließlich des Gehirns (Enzephalopathie), Kopfschmerzen, Zucken oder Zittern und Schwindel
- Schnelle Herzfrequenz und Veränderungen des Herzrhythmus (Arrhythmie)
- Starke Müdigkeit
- Husten
- Verdauungsauffälligkeiten wie Übelkeit, Erbrechen, verminderter Appetit, Durchfall und Verstopfung
- Fieberhafte Neutropenie (Fieber, das mit dem Rückgang der Anzahl der Neutrophilen verbunden ist – eine Art weißer Blutkörperchen, die Infektionen bekämpft)
Die schwerwiegendsten Nebenwirkungen werden im Folgenden ausführlicher beschrieben:
Cytokin-Freisetzungssyndrom
Eine der häufigsten und schwerwiegendsten Komplikationen der CAR-T-Zell-Therapie ist das »Cytokin-Release-Syndrome« (CRS, Zytokinsturm). Es kann auftreten, da die CAR-T-Zell-Behandlung eine massive Immunreaktion im Körper hervorruft. Dadurch setzen die von der Behandlung betroffenen weißen Blutzellen Substanzen im Blut frei, die als »Zytokine« bezeichnet werden. Zytokine sind Proteine, die anderen Zellen signalisieren, dass sie bei einer Immunantwort helfen sollen. Wenn viele Zytokine gleichzeitig freigesetzt werden, kann dies den Körper insgesamt überfordern.
Symptome eines CRS können Fieber, Schüttelfrost, niedrigen Sauerstoffgehalt im Blut, schnelle Herzfrequenz und niedrigen Blutdruck umfassen. In der Regel treten diese Symptome wenige Tage nach der CAR-T-Zell-Infusion auf, sie können sich aber auch bis zu 14 Tage danach zeigen. Etwa die Hälfte aller Behandelten durchläuft aufgrund des Wirkprinzips der CAR-T-Zell-Therapie ein gewisses Maß an CRS. Die meisten Fälle sind mild und leicht zu behandeln. Es können auch schwere, lebensbedrohliche Reaktionen auftreten – man spricht dann auch von einem Zytokinsturm. Patientinnen und Patienten mit schwerem CRS müssen möglicherweise zur Behandlung der Nebenwirkungen auf eine Intensivstation gebracht werden. Dort erhalten sie gegebenenfalls Sauerstoff und Flüssigkeit. Möglicherweise wird ihnen auch ein Medikament namens »Tocilizumab« verabreicht, das die Immunantwort dämpfen kann.
Weitere Immunreaktionen
Weil die CAR-T-Zell-Therapie das Immunsystem beeinflusst, haben die Behandelten ein erhöhtes Infektionsrisiko, einschließlich schwerer Infektionen. Ursache dafür sind unter anderem die Verringerung der weißen Blutzellen (speziell der B-Lymphomzyten) und damit einhergehende niedrige Antikörperspiegel. Antikörper sind Proteine, die von B-Zellen produziert werden, um Infektionen zu bekämpfen. Wenn sie nur in geriner Anzahl vorhanden sind, kann es für den Körper schwieriger sein, Infektionen abzuwehren. Vorbeugend werden daher möglicherweise Medikamente verabreicht, die eine Infektion verhindern oder diese abwehren (zum Beispiel Antibiotika). Wenn die Antikörperspiegel sehr niedrig sind, kann gegebenenfalls auch eine Immunglobulin-Ersatztherapie (Infusion von Antikörpern) vorgenommen werden. Weiterhin wird das medizinische Team im Vorfeld prüfen, ob erfolgte Impfungen weiterhin wirksam sind oder ob eine Impfung, abhängig von den persönlichen Gegebenheiten, sinnvoll ist.
Probleme im Bereich des Nervensystems
Probleme im Bereich des Nervensystems treten bei den meisten der mit CAR-T-Zellen behandelten Patientinnen und Patienten wenige Tage nach der Behandlung auf – manchmal können sich diese Beschwerden aber auch bis zu acht Wochen nach der CAR-T-Zell-Gabe zeigen. Die Beeinträchtigungen des Nervensystems sind in der Regel leicht und bessern sich über ein paar Wochen wieder. Am häufigsten treten Probleme mit der Funktionsweise des Gehirns auf und Patienten leiden unter Kopfschmerzen, Zittern, Schwindel, Verwirrtheit, Schlafstörungen und Sprachproblemen. Auch lebensbedrohliche Schwellungen des Gehirns können auftreten. Um diese Probleme des Nervensystems zu behandeln, können Steroide verabreicht werden. Das Behandlungsteam kennt diese Symptome und wird die Patienten engmaschig überwachen.
Vergleich der Nebenwirkungsprofile
Die Nebenwirkungen sind bei den bisher zugelassenen kommerziellen CAR-T-Zell-Therapien qualitativ vergleichbar, allerdings scheint der Anteil an Patienten, die Beeinträchtigungen im Bereich des Nervensystems entwickeln, unter Axicabtagene-Ciloleucel höher als bei Anwendung von Tisagenlecleucel. Da es keine direkten Vergleich der zugelassenen Präparate gibt, kann man aber nicht sagen, ob eines besser wirksam oder besser verträglich als das andere ist. Die Wahl des Präparats wird Ihr Behandlungsteam mit Ihnen besprechen.