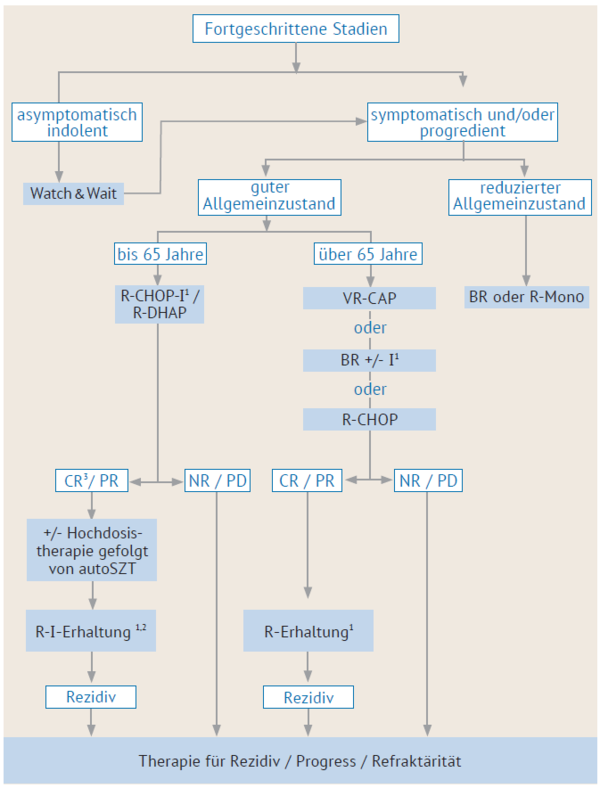
Für alle hier beschriebenen Therapiemöglichkeiten gilt leider die Regel: Keine Wirkung ohne Nebenwirkung. Bestrahlungen, chemotherapeutische Wirkstoffe, Antikörper, neuere Medikamente und Stammzelltransplantationen haben neben der erwünschten Zerstörung oder Hemmung der Tumorzellen auch Auswirkungen auf gesunde Zellen, Gewebestrukturen oder Organe. Dabei unterscheidet man zwischen den akuten Nebenwirkungen, die während oder unmittelbar nach der Behandlung auftreten, und den Spätfolgen einer Behandlung. Während sich die akuten Nebenwirkungen meist in einem überschaubaren Zeitrahmen zurückbilden oder durch geeignete Maßnahmen während der Behandlung vermieden oder reduziert werden können, treten Spätfolgen oft erst Jahre nach der Behandlung auf.
Was passiert, wenn ich mich nicht behandeln lasse?
Angesichts der Risiken und Nebenwirkungen fällt manchen Erkrankten die Entscheidung für eine bestimmte Therapie nicht leicht. Im gemeinsamen Gespräch mit den behandelnden Ärzt:innen sollte überlegt werden, welches Ziel mit der Therapie verfolgt wird und welche Risiken und Nebenwirkungen in Kauf zu nehmen sind. Auf jeden Fall sollte man sich bewusst machen, dass eine Behandlung die einzige Chance bietet, die Krankheit zurückzudrängen oder ihre Beschwerden zu lindern. Die Nichtbehandlung eines aggressiv verlaufenden Mantelzell-Lymphoms führt dazu, dass die erkrankte Person nach kurzer Zeit an dieser Erkrankung stirbt.
Welche Nebenwirkungen haben Chemotherapien?
Akute Nebenwirkungen der Chemotherapie entstehen dadurch, dass die den Tumor angreifenden Substanzen auch gesunde Körperzellen beeinträchtigen. Betroffen sind insbesondere jene Zellen, die sich schnell teilen, wie z.B. die Schleimhäute in Mund und Darm, die Haarwurzeln und die blutbildenden Zellen des Knochenmarks. Die Stärke der Nebenwirkungen ist abhängig von der Art und Dosierung des Wirkstoffes, sie kann sich aber auch bei jedem Behandelten anders darstellen.
Übelkeit und Erbrechen, die häufig einige Stunden nach einer chemotherapeutischen Behandlung auftreten können, lassen sich durch entsprechende Zusatzmedikamente (= Antiemetika, Arzneimittel gegen Übelkeit und Erbrechen) erheblich abschwächen oder gar verhindern. Eintretender Haarausfall bildet sich nach dem Abschluss der Therapie fast immer zurück.
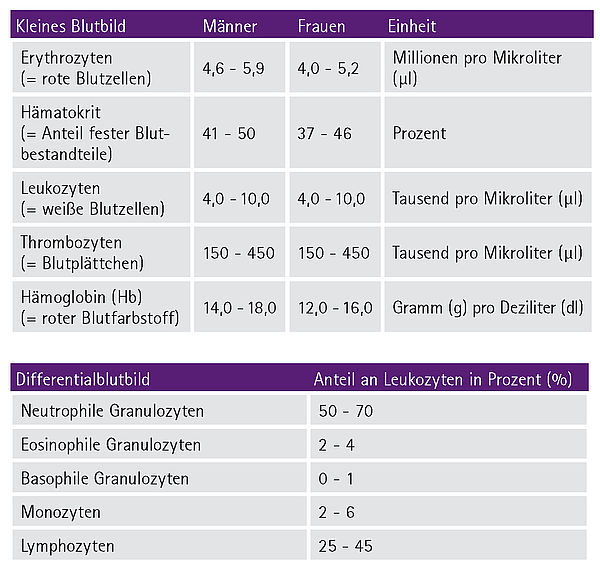
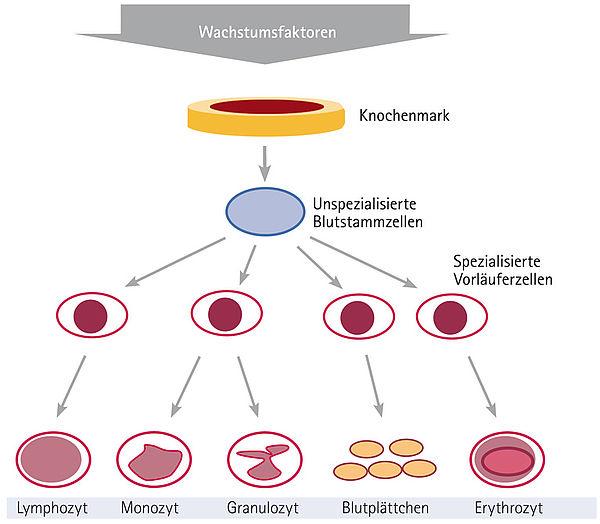
Durch die Chemotherapie kommt es außerdem zu einer vorübergehenden Störung der Blutbildung, aus der sich oft eine Blutarmut (= Anämie) entwickelt. Obwohl Patient:innen die Anämie nicht so schnell bemerken, ist besondere Vorsicht geboten. Denn fehlende weiße Blutzellen (= Leukopenie) und insbesondere das Fehlen von neutrophilen Granulozyten (= Neutropenie) erhöhen über mehrere Tage das Risiko, an einer lebensbedrohlichen Infektion zu erkranken, insbesondere im Bereich der Atmungsorgane. Um Lungenentzündungen oder Infekten im Mund oder im Hals- und Rachenraum vorzubeugen, empfehlen sich bei sehr niedrigen Leukozytenwerten (weniger als 1.000 Leukozyten pro Mikroliter) besondere Vorsichtsmaßnahmen, wie z.B. die Vermeidung von Menschenansammlungen oder die vorbeugende Einnahme von Antibiotika. Dass auch die roten Blutzellen geschädigt sind, zeigt ein sehr niedriger Hämoglobin-Spiegel (= Hb-Wert) im Blut an. Ein Mangel dieses Sauerstoffbindenden Blutfarbstoffs kann zu allgemeiner Schwäche, leichter Ermüdbarkeit und Kurzatmigkeit führen. Ein Mangel an Blutplättchen (= Thrombopenie) führt in seltenen Fällen zu spontanen Blutungen.
Aus der Gesamtproblematik heraus sollte das Blutbild regelmäßig während und nach einer Chemotherapie kontrolliert werden, um rechtzeitig Gegen- oder Vorsichtsmaßnahmen einleiten zu können. In manchen Fällen ist auch die Gabe von Medikamenten erforderlich, die das Wachstum von blutbildenden Zellen anregen. Diese Medikamente werden meist als Wachstumsfaktoren bezeichnet oder kurz G-CSF für engl. Granulocyte-Colony Stimulating Factor (= dt. Granulozyten-Kolonie stimulierender Faktor). Ganz selten ist eine Bluttransfusion notwendig. Eine Erholung des Blutbildes sollte vor jedem neuen Chemotherapiezyklus eingetreten sein. Auch die Herz- und Lungenfunktion sollten während und nach einer Chemotherapie regelmäßig überprüft werden. Ob diese durch die Chemotherapie beeinträchtigt werden, ist wiederum von den eingesetzten Medikamenten und der Gesamtdosis abhängig und kann sich bei jedem Behandelten anders darstellen. Manche Patient:innen entwickeln als langfristige Folge der Chemotherapie eine Herzschwäche.
Einzelne chemotherapeutische Wirkstoffe, insbesondere das Vincristin, können Schmerzen oder Gefühlsstörungen (Kribbeln, Pelzigkeitsgefühl) an Händen und Füßen auslösen. Diese nach und nach einsetzende Nebenwirkung wird mit dem Fachwort „Polyneuropathie“ bezeichnet. Je nach Ausmaß der Beschwerden sollte während der Therapie erwogen werden, das verursachende Medikament zu reduzieren oder ganz weg zu lassen. Meist entwickelt sich diese Gefühlsstörung dann zurück. Einige Patient:innen berichten aber auch von länger anhaltenden Polyneuropathien.
Als seltene, aber schwerwiegende Langzeitfolge nach einer Chemotherapie gilt das erhöhte Risiko, einige Jahre später Sekundärtumore zu entwickeln. Dabei handelt es sich um eine erneute Krebserkrankung, die wieder das lymphatische System betreffen kann, aber auch das Blut oder andere Organe.
Welche Nebenwirkungen hat die Strahlentherapie?
Ob und welche Nebenwirkungen eine Strahlentherapie in den seltenen Fällen mit lokalisiertem Befall verursacht, hängt von der Dosierung der Strahlen ab und davon, ob der ganze Körper oder nur einzelne Körperregionen bestrahlt werden bzw. um welche Körperregionen es sich dabei handelt. Nur wenige Patient:innen erleiden schwere oder bleibende Nebenwirkungen. Bei den meisten Patient:innen treten nur vorübergehende Beschwerden auf, wie z.B. Schleimhautschäden in Mund, Speiseröhre und Darm. Manche berichten nach einigen Tagen auch über zunehmende Müdigkeit, ein allgemeines Krankheitsgefühl, Abgeschlagenheit, Appetitlosigkeit oder Kopfschmerzen. Werden auch das blutbildende Knochenmark des Beckenknochens oder die Wirbelsäule bestrahlt, besteht eine höhere Anfälligkeit für Infekte. Auch durch eine Strahlentherapie können in seltenen Fällen Jahre bis Jahrzehnte später Zweittumore entstehen.
Wie verträglich sind Antikörper und neue Substanzen?
Der Antikörper Rituximab ist vergleichsweise gut verträglich, aber ebenfalls nicht frei von Nebenwirkungen. Insbesondere während der ersten Infusion kommt es bei einigen Patient:innen zu Fieber und Schüttelfrost. Manche Patient:innen berichten auch über Übelkeit, Schwäche, Kopfschmerzen, Atembeschwerden, Schwellungen im Mund- oder Rachenraum und Hautausschlag. Diese Beschwerden beginnen und enden meist innerhalb der Zeit, in der die Infusion durchläuft und können durch Zusatzmedikamente gut behandelt werden. Ursache dieser Nebenwirkungen kann die Überempfindlichkeit gegen den aus Eiweiß bestehenden Antikörper sein. Bei Betroffenen mit einer großen Tumorlast (= viele Lymphomzellen im Körper) treten die Nebenwirkungen auch bedingt dadurch auf, dass durch den Antikörper in relativ kurzer Zeit große Mengen von Tumorzellbestandteilen im Körper freigesetzt werden. Diese Beschwerden würden dann von Behandlung zu Behandlung abnehmen, da auch die Menge der Tumorzellen kontinuierlich im Verlauf der Therapie abnimmt.
Gibt es besondere Risiken bei der autologen Stammzelltransplantation?
Ein Vorteil der autologen Stammzelltransplantation besteht darin, dass sich die übertragenen „eigenen“ Zellen auf jeden Fall mit dem Körper vertragen. Allerdings dauert es trotzdem mehrere Wochen, bis die Blutbildung und die Produktion von Abwehrzellen durch die übertragenen Stammzellen wieder in Gang gekommen ist. Mögliche Risiken und Belastungen ergeben sich in einem Zeitraum niedriger Leukozytenwerte (meistens ca. zwei Wochen nach der vorausgehenden Hochdosistherapie. In dieser Zeit sind die behandelten Personen abwehrgeschwächt und müssen stationär überwacht werden, um schwere Infektionen zu vermeiden bzw. um unmittelbar mit Antibiotika behandelt zu werden. Nach ca. drei Wochen können die Patient:innen in der Regel entlassen werden, aber häufig dauert es noch einige Wochen, bis der Allgemeinzustand vollständig wiederhergestellt ist.
Welche Risiken bestehen bei einer allogenen Stammzelltransplantation?
Speziell die allogene Stammzelltransplantation ist eine risikoreiche und belastende Behandlung, die nur in hochspezialisierten Transplantationszentren mit sterilen Isolierstationen durchgeführt werden kann. Risiken und Belastungen ergeben sich einerseits aus der vorausgehenden Hochdosistherapie (= Chemotherapie und ggf. Strahlentherapie), die das Knochenmark zerstört und die Immunabwehr des Erkrankten gänzlich zum Erliegen bringt. In dieser Zeit muss alles getan werden, um eine Infektion mit Krankheitserregern zu vermeiden. Welche konkreten vorbeugenden Maßnahmen und Verhaltensregeln sinnvoll sind, wird individuell in einem Aufklärungsgespräch im Transplantationszentrum besprochen.
Bei der allogenen Transplantation besteht zusätzlich die Gefahr, dass die transplantierten Stammzellen nicht im Knochenmark „anwachsen“. Und obwohl bei der allogenen Transplantation auf eine größtmögliche Übereinstimmung bestimmter Gewebemerkmale (= HLA-Merkmale) zwischen der spendenen und der empfangenden Person geachtet wird, tritt dennoch häufiger eine Unverträglichkeit der übertragenen Spenderzellen mit den Organen und dem Gewebe des Empfängers auf. Dies kann dazu führen, dass sich die übertragenen Abwehrzellen gegen die eigenen Gewebezellen richten. Schäden an Haut, Darm und Leber, die mitunter auch lebensbedrohlich werden, können die Folge sein. Eine solche Reaktion wird als Transplantat-gegen-Wirt- Reaktion bezeichnet. Diese Immunreaktion muss dann über einen längeren Zeitraum durch Medikamente (= Immunsuppressiva) unterdrückt werden und verlängert die Zeit, in der diese Patient:innen einem erhöhten Infektionsrisiko ausgesetzt sind.
Welche Auswirkungen haben die Therapien auf die Fruchtbarkeit?
Auch wenn hauptsächlich ältere Menschen an einem Mantelzell-Lymphom erkranken, ist diese Frage für jüngere MCL-Patient:innen nicht unwichtig. Da auch die Keimzellen (Ei- und Samenzellen) durch die Therapie geschädigt werden, sollten auf jeden Fall empfängnisverhütende Maßnahmen getroffen werden, um eine mögliche Schwangerschaft in dieser Phase zu verhindern.
Ob die Therapie bei Männern zu einer bleibenden Zeugungsunfähigkeit führt, hängt von der Dosierung und der Art der eingesetzten Medikamente oder Strahlen ab. Diese Spätfolge sollte vor Beginn der Behandlung mit dem Behandlungsteam besprochen und ggf. die Möglichkeit einer Spermakryokonservierung (= Einfrieren von Samenzellen) in Betracht gezogen werden. Bei Frauen kann die Chemotherapie zu einer vorzeitig einsetzenden Menopause (= Wechseljahre) führen. Abhängig vom Alter der Patientin und der Medikamentendosis kann es jedoch auch zu einer vollständigen Erholung der Eierstöcke und der Empfängnisfähigkeit kommen. Über Möglichkeiten zum Schutz der Eierstöcke oder zur Konservierung von befruchteten oder unbefruchteten Eizellen informiert das Projekt „fertiPROTEKT“.